新闻资讯
最新公告
联系我们
点金教育教学点一:圣地校区
地址:圣地公寓A座11层
电话:17705481602
点金教育教学点二:擂鼓石校区
地址:擂鼓石路与傲徕峰路交界处西90米路北
电话:17705484007
点金教育教学点三:奥园校区
地址:奥林匹克花园南门西三楼东南
电话:17705484006
点金教育教学点四:云集校区
地址:灵山大街泰山云集商业街1号楼3层
电话:15662057268
点金教育教学点五:青年路校区
地址:青年路82号5层
电话:17705484005
化学中常用的物理量
发布日期:2016/4/7 12:58:14 点击:3375
课题:第3节 化学中常用的物理量———物质的量(第一课时)
知识与技能:
1.使学生了解物质的量及其单位摩尔,了解物质的量与微观粒子数之间的关系。
2.使学生了解学习物质的量这一物理量的重要性和必要性。
3.使学生了解阿伏加德罗常数的含义。
过程与方法:
1. 初步培养学生的演绎推理、逻辑推理、抽象概括、分析比较的能力。
2. 培养学生的计算能力,并通过计算帮助学生更好地理解概念和运用、巩固概念。
情感、态度与价值观:
1. 使学生认识到微观和宏观的相互转化是研究化学的科学方法之一,培养学生尊重科学的思想。
2. 通过学习,了解概念的形成过程及形成条件,激发学生对新问题的探究兴趣。
3. 强调解题规范,养成良好的计算习惯。
教学重点:物质的量及其单位摩尔。
教学难点:物质的量的概念。
教学过程:
[导入新课]物质是由非常小的原子、分子、离子等构成的。它们小到什么程度呢?比如一滴水滴,它由17后面19个0这么多的水分子构成,
我们的化学家需要研究如此巨大数量的分子、原子很不方便,怎么办呢?科学家引入了“物质的量”这个物理量来表示一定数目的原子、分子、离子等微观粒子。
[板书] 化学中常用的物理量———物质的量
[推进新课]就像长度可以表示物体的长短,温度可用来表示物体的冷热程度一样,物质的量可用来表示物质所含粒子数目的多少,其符号为n,它是国际单位制中7个基本物理量之一,是一专有名词,使用时“物质的量”四个字不能分开。
每个物理量都有单位,长度单位米,符号m,质量符号kg,物质的量也有单位,是摩尔,符号mol,简称摩。
(投影)
物理量名称(符号) 单位名称 单位符号 衡量标准
长度(L) 米 m 光在真空中于1/299792458秒时间间隔内所经路径的长度为
质量(m) 千克(公斤) kg 国际千克原器的质量为
物质的量(n) 摩(尔) mol
[板书]一、物质的量(n)
1. 是一个物理量,单位:摩尔(mol)
[过渡]物理量长度表示物体的长短,
(学生活动)阅读教材20~21页
[讨论] 1摩尔粒子的数目是多少?
[学生1]
[学生2]阿伏加德罗常数个。
[学生3]约为6.02ⅹ1023个。
[板书]2. 1mol物质所含有的粒子数
①
② 阿伏加德罗常数个
③ 约为6.02ⅹ1023个
(投影)衡量标准:
[设问] 阿伏加德罗常数是什么?阿伏加德罗是意大利物理学家,因他对6.02ⅹ1023这个数据的测得有着很大的贡献,故用其名字来表示1mol任何粒子的数目。阿伏加德罗常数近似等于6.02ⅹ1023(是近似值,就好比л与3.14的关系),化学上我们用NA来表示阿伏加德罗常数,其单位为mol-1。
[板书] 3. 阿伏加德罗常数(NA)单位mol-1
近似等于6.02ⅹ1023
[讲解]在平时的计算中,我们通常用6.02ⅹ1023这个数值代替阿伏加德罗常数。
[提问]1mol小麦约含6.02ⅹ1023个麦粒,这句话是否正确,为什么?
[学生]不正确。因为物质的量及其单位摩尔的使用是微观粒子。因此,在使用时应指明粒子的名称,注明具体化学式。
(投影练习)
1. 判断下类说法是否正确
(1)1mol氢 (2)1molCO2 (3)1mol Clˉ (4)摩尔是七个基本物理量之一
(5)1mol是6.02ⅹ1023个微粒的集合体
[学生1](1)错误。没有指明微粒的种类。改成1mol H,1mol H2都是正确的。因此使用摩尔作为单位时,所指粒子必须十分准确,且粒子种类用化学式表示。
[学生2](2)正确。
[学生3](3)正确。
[学生4](4)错误。物质的量是基本物理量之一,摩尔是它的单位,不能把二者混为一谈。
[学生5](5)错误。6.02ⅹ1023是阿伏加德罗常数的近似值,二者不能简单等同。
2. 填空
(1)1mol O2含有 个氧分子, 个氧原子,合 mol O。
(2)1.204ⅹ1024个N2的物理的量为 ,氮原子物质的量是
[引导]由以上练习,我们可得出粒子的总个数N、阿伏加德罗常数NA、物质的量n三者之间的关系为:
[板书]5.物质的量(n)、粒子数(N)和阿伏加德罗常数(NA)三者之间的关系用符号表示:![]()
6.一定物质的量的物质所含原子数或离子数(原子团)与化学式有关,且成正比。
(投影练习)
4.在 mol Al2(SO4)2中含SO42ˉ0.3mol,含Al3+ mol。
5. 1mol水中,共含原子 mol,其中H mol,O mol,质子 mol,电子 mol。
6. 1mol SO42ˉ所带负电荷为 个,总共含 mol电子。
[提问]为什么在数值上等于它的相对分子质量?
[学生]因为单位不同。
[教师]很正确。
[课堂小结]本节课我们学习了一个新的物理量——物质的量。这一概念较为抽象,请大家注意其适用范围及有关计算。
[布置作业]
1. 与0.2mol H2O含有相同氢原子数的是 ( )
2.等物质的量CO和CO2所含原子数之比为 。
3. 将CaCl2溶解在1mol H2O中,欲使Clˉ与水分子的物质的量之比为1:10,则应取CaCl2的物质的量为多少?
板书设计
第3节 化学中常用的物理量———物质的量
一、物质的量(n)
1.是一个物理量,单位:摩尔(mol)
2. 1mol物质所含有的粒子数
①
② 阿伏加德罗常数个
③ 约为6.02ⅹ1023个
3. 阿伏加德罗常数(NA)单位mol-1
近似等于6.02ⅹ1023
4.适用范围:微观粒子,如原子、分子、离子、质子、中子、电子等注明具体化学式。
5.物质的量(n)、粒子数(N)和阿伏加德罗常数(NA)三者之间的关系用符号表示:![]()
6.一定物质的量的物质所含原子数或离子数(原子团)与化学式有关,且成正比。
[布置作业]
课题:第3节 化学中常用的物理量----物质的量(第二课时)
知识与技能:
1.使学生了解摩尔质量的概念,了解摩尔质量与相对原子质量、相对分子质量之间的关系。
2.使学生了解气体摩尔体积的概念及标准状况下的气体摩尔体积。
3.使学生了解物质的量、摩尔质量与物质的质量之间的关系,以及物质的量与气体体积、气体摩尔体积之间的关系。
过程与方法:
1.通过对数据的分析比较,培养学生的分析问题、科学处理数据的能力。
2.,培养学生的计算能力,并通过计算帮助学生更好地理解概念和运用、巩固概念。
3.培养学生逻辑推理、抽象概括的能力。
情感、态度与价值观:
1.使学生认识到微观和宏观的相互转化是研究化学的科学方法之一,培养学生尊重科学的思想。
2.通过学生的置疑、解疑,激发学生对问题的探究兴趣及探究能力。
3.通过计算,强调解题规范,养成良好的计算习惯。
教学重点:摩尔质量的概念、气体摩尔体积的概念。
教学难点:摩尔质量的概念、气体摩尔体积的概念。
[教学过程]
[导入新课]什么是物质的量?什么是摩尔?它们的使用范围是什么?
[学生]物质的量是表示物质所含粒子多少的物理量,摩尔是物质的量的单位。每摩尔物质都含有阿伏加德罗常数个粒子,阿伏加德罗常数的近似值为6.02×1023mol-1。物质的量和摩尔都只适用于微观粒子,不能用用于宏观物体。
[讲述]既然物质的量是联系微观粒子和宏观物体的桥梁,那么,物质的量是如何把微观粒子与宏观质量、体积联系起来的呢?这节课我们就来研究物质的量与质量、气体体积之间的关系。
[推进新课]分析书中表格l一3—1中列出的1mol 物质的质量与其相对原子质量或相对分子质量的关系。
[学生]1mol原子的质量在数值上等于它的相对原子质量。1mol分子的质量在数值上等于它的相对分子质量。
[提问]那么,对于粒子中的离子来讲,又将怎样呢?
[学生]对于离子来说,由于电子的质量很小,当原子得到或失去电子变成离子时,电子的质量可略去不计,因此,1mol离子的质量在数值上等于该离子的式量。
[板书]二、摩尔质量
1. 1mol任何粒子或物质的质量以克为单位时,在数值上都等于它的相对原子质量或它的相对分子质量。
[讲解]化学上,我们把1mol物质所具有的质量叫做摩尔质量,符号M。
[板书]2.摩尔质量定义:
(1)单位物质的量的物质所具有的质量叫做摩尔质量,符号M。
(2)单位:g/mol或 kg/mol。
(3)数值上等于物质或粒子的式量。
 [讲解]也就是说,物质的摩尔质量是该物质的质量与该物质的物质的量之比,可表示为:
[讲解]也就是说,物质的摩尔质量是该物质的质量与该物质的物质的量之比,可表示为:
[板书]3.计算式:

符号表示:
[讲解]依据此式,我们可以把物质的质量与构成物质的粒子集体——物质的量联系起来。
(投影练习)O的摩尔质量是 ;
O2的摩尔质量是 ;
NaCl的摩尔质量是 ;
SO42- 的摩尔质量是 。
答案:
[强调]大家在解答有关摩尔质量的问题时,一定要注意单位。
(投影练习)欲使SO2和SO3中氧元素的质量相等,SO2与SO3的质量比是多少?
分析与解答:根据氧元素质量相等,推出氧元素的物质的量相等,求出SO2和SO3物质的量比为3:2,最后得出SO2与SO3的质量比为6:5。
(投影练习)71 gNa2SO4中含有Na+和SO42ˉ物质的量各为多少?
解:Na2SO4的相对分子质量为142,则M(Na2SO4)=
Na2SO4 = 2Na+ + SO42ˉ
n (Na+) = 2 n(Na2SO4) = 2×0.5mol = 1 mol
n (SO42ˉ) = n (Na2SO4) = 0.5mol
答:71 gNa2SO4中含有Na+ 物质的量为1 mol,SO42ˉ物质的量为0.5mol。
[讨论]分析书中表格1—3—1,列出有关化学式、体积的相关数据,讨论并回答下列三个问题。
(多媒体投影)问题1:分析体积一栏,发现单位是否相同,说明什么问题?
问题2:在同温同压下,1 mol固体、液体的体积是否相同?
问题3:在同温同压下,1 mol气体的体积是否相同?温度、压强不同时,又怎么样?
[学生]讨论,探究。
[学生1]1.固体、液体体积单位是cm3,而气体体积单位是L,
[学生2]2.在同温同压下,1 mol固体、液体的体积不同。
[学生3]3.在同温同压下,1 mol气体的体积基本相同。不同温度、压强下,1 mol气体的体积不同。
(多媒体投影)问题1:固体、液体体积为何不同?与气体体积为何有如此大的差距?
问题2:同温同压下,1 mol不同气体的体积为何相差不大?
问题3:不同温度、压强下,1 mol气体体积为何不同?
[讨论]请大家阅读22~23页及图1—3—1,讨论分析:为什么会产生这些差异?
[学生]讨论,探究。
[提问]物质体积的大小取决于那些因素?
[学生]物质体积的大小取决于物质微粒数的多少、微粒本身的大小和微粒之间的距离三个因素。
[提问]当微粒数一定时,固体、液体的体积主要决定于什么因素?
[学生]当微粒数一定时,固体、液体的体积主要决定于微粒本身的大小,而气态物质的体积主要决定于微粒之间的距离。
[提问]为什么相同条件下,1 mol固、液态物质所具有的体积不同,而1 mol气态物质所具有的体积却基本相同?
[学生]在固、液态中,微粒本身的大小不同,决定了其体积不同,而不同气体在一定温度和压强下,分子之间的距离可以看作是相同的,所以,1 mol气体有着近似相同的体积。
[提问]为什么比较一定量气体的体积,要在相同的温度、压强下进行?
[学生]因为气体的体积受温度、压强的影响很大,故说到气体体积时必须指明外界条件。
[讲解]对固体,我们用得较多的是质量,而对于气体,用得较多的则是体积。由于同温同压下,1 mol不同气体都含有相同的体积,为我们定量测定气体体积提供了很大的方便,为此,我们专门提出了气体摩尔体积的概念。
[板书]三、气体摩尔体积( Vm )
[讲解]所谓气体摩尔体积( Vm )指的是一定温度和压强下,单位物质的量的气体所占的体积。
[板书]1.定义:一定温度和压强下,单位物质的量的气体所占的体积。符号为Vm。
 [讲解]气体的体积与气体物质的量之比,可表示为:
[讲解]气体的体积与气体物质的量之比,可表示为:
[板书]表达式:
[提问]由此可知,Vm的单位是什么呢?
[学生]气体体积的单位是L或m3,物质的量的单位mol,所以气体摩尔体积的单位是L·mol-1或m3·mol-1。
[板书]单位:L·mol-1或m3·mol-1
[讲解]在不同外界条件下,都有一个与之对应的气体摩尔体积,我们把温度
[板书]2.标准状况下(STP) ,1 mol任何气体的体积都约为22.
[讲解]大家在掌握气体摩尔体积这个概念时,一定要注意以下几点:
[板书](1)适用范围:任何气体(包括混合气体)
(2)条件:在一定温度和压强下(标准状况下Vm为22.
(投影练习)判断下列说法是否正确,并说明理由:
1.1molO2的体积约是22.
2.标准状况下,H2的体积为22.
3.标准状况下,1mol H2的体积恰好为22.
4.标准状况下,1mol H2SO4的体积约为22.
5.标准状况下,0.4molN2和0.6molO2的混合气体的体积约为22.
6.22.
[学生]1.错误。未指明条件、状况。
2.错误。未指明1mol。
3.错误。22.
4.错误。H2SO4不是气体。
5.正确。
6.错误。未指明气体体积是否在相同条件下测定。
[讨论]请大家思考:同温同压下,体积相同的气体的物质的量是否相同?所含分子数是否相同?
 [学生]讨论,探究。
[学生]讨论,探究。
[学生1]根据公式 ,同温同压下,气体摩尔体积一定,气体体积与物质的量成正比,所以体积相同的气体的物质的量相同。
[学生2]根据公式 ![]() , NA是一定值,所以N与物质的量n成正比,
, NA是一定值,所以N与物质的量n成正比,
由物质的量相同,推出所含分子数相同。
[小结]同温同压下,相同体积的任何气体都含有相同数目的分子,这一规律被称为阿伏加德罗定律。
 [板书]3.阿伏加德罗定律:在同温同压下,相同体积的任何气体都含有相同数目的分子。
[板书]3.阿伏加德罗定律:在同温同压下,相同体积的任何气体都含有相同数目的分子。
即同温同压下 ,适用对象是气体。
[讲解]阿伏加德罗定律还有几个重要的推论。我们可以根据公式pV = nRT(其中p为压强,V为气体体积,n为气体的物质的量,R为常数,T为温度)导出,在一定条件下p~n、ρ~M、V~M之间的关系。
[课堂小结]通过这节课的学习,我们把质量、气体的体积这两个宏观物理量与微粒数这一微观粒子联系起来了。
[板书]小结:

[布置作业]P26-27 练习1、2
[板书设计]
二、摩尔质量
1. 1mol任何粒子或物质的质量以克为单位时,在数值上都等于它的相对原子质量或它的相对分子质量。
2.摩尔质量定义:
(1)单位物质的量的物质所具有的质量叫做摩尔质量,符号M。
(2)单位:g/mol或 kg/mol。
 (3)数值上等于物质或粒子的式量。
(3)数值上等于物质或粒子的式量。
3.计算式:
 符号表示:
符号表示:
三、气体摩尔体积( Vm )
 1.定义:一定温度和压强下,单位物质的量的气体所占的体积。符号为Vm。
1.定义:一定温度和压强下,单位物质的量的气体所占的体积。符号为Vm。
表达式:
单位:L·mol-1或m3·mol-1
2.标准状况下(STP) ,1 mol任何气体的体积都约为22.
(1)适用范围:任何气体(包括混合气体)
(2)条件:在一定温度和压强下(标准状况下Vm为22.
 3.阿伏加德罗定律:在同温同压下,相同体积的任何气体都含有相同数目的分子。
3.阿伏加德罗定律:在同温同压下,相同体积的任何气体都含有相同数目的分子。
即同温同压下 ,适用对象是气体。
小结:
课题:第3节 化学中常用的物理量----物质的量(第三课时)
知识与技能:
1.使学生理解, 物质的量浓度的概念;。
2.使学生学会一定物质的量浓度溶液的配置方法。
过程与方法:
1.在概念教学中,提高学生的思维能力;
2.通过配置一定物质的量浓度溶液的教学,培养学生的观察能力、分析问题、解决问题和动手实验的能力。
情感、态度与价值观:
1.通过实验激发学生学习化学的兴趣,培养学生严谨求实的科学作风;
2.通过计算,强调解题规范,养成良好的计算习惯。
教学重点:
物质的量浓度的概念,有关物质的量浓度的计算,一定物质的量浓度溶液的配制。
教学难点:
1.物质的量浓度与质量分数之间的换算。
2.气体溶质物质的量浓度的计算。
3.正确配制一定物质的量浓度的溶液。
教学用具:烧杯、容量瓶、量筒、玻璃棒、教头滴管、托盘天平、洗瓶、试剂瓶、标签、药匙、氯化钠固体药品
教学过程:
[导入新课]在实验室的试剂瓶上,我们经常可以看到NaOH 10%、NaOH 1mol/L、HCl 2mol/L……,10%表示什么意思?
[学生]溶液的质量分数,定量地表示溶液的浓度。
[提问]质量分数怎么表示?
[学生]![]()
[过渡推进新课]NaOH 1mol/L这应该也是用来表示溶液的浓度的,今天我们就来学习溶液浓度的另一种表示方法。
[板书]一、物质的量浓度
1.定义:以单位体积的溶液中所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。
符号:c(B) 单位:mol/L 或 mol/m3
(学生自学、思考,引导学生对概念进行理解)
[学生]物质的量浓度即指
[板书]2.含义:表示
3.表达式:![]()
符号表示:![]()
[ 练习]0.5mol/L NaOH溶液的含义是什么?
[学生]
[引导]从上述
[学生]仍为0.5mol/L。
(练习)请根据定义判断下面哪种情况可得到0.5mol/L的Na2CO3溶液?
A
B
C
D.
答案: CD
[归纳小结]关键是取一定溶质后加水至一定量,而不是加一定量的水.
(练习)
(分析与解)胆矾溶于水所得溶液的溶质为硫酸铜,硫酸铜物质的量为0.1mol,所以溶液的物质的量浓度为0.1mol/L.
(投影)小结注意事项:
①溶质可以是化合物,也可以是离子,要用物质的量表示.
②要用溶液的体积,不是溶剂的体积,单位一般是L.
③在一定物质的量浓度的溶液中,取出任意体积,其各种浓度均不变,但溶质物质的量要随着变化.
④带有结晶水的物质溶于水时,所得溶液物质的量的计算以失去水的物质为溶质进行计算.
[激发兴趣]在化学实验中,我们经常要用到各种各样浓度的溶液,那么我们的实验员是如何来精确配置这些不同物质的量浓度溶液的呢?我们也试着做一回实验员。
[例]现欲配置100mL 2mol/L NaCl溶液,请你利用实验室中固体NaCl试剂,完成配制任务。
[引导]如何知道取固体NaCl多少呢?
[学生]![]()
[继续提问]0.2mol溶质氯化钠固体如何得到呢?
[学生]称量。
[继续引导]我们能称的是质量,0.2mol怎么称呢?
[学生]根据公式m(NaCl)=n(NaCl)•M(NaCl)计算出NaCl的质量为
[继续引导]但是
[学生]将
[疑问]这样得到的溶液体积是100mL吗?
[学生]不是。
[引导]那怎么解决?
[学生]可将11.7gNaCl溶于水后,然后再将溶液配成100mL。
[提问]用什么仪器呢?烧杯行吗?量筒行吗?
[学生]不行。烧杯是粗略测量体积的仪器,量筒不能用于配溶液。
[讲授]在这儿我们介绍一种较为精密的仪器叫容量瓶。
请大家阅读本书24页有关容量瓶的介绍。回答问题。
(实物展示)
1. 容量瓶规格
2. 容量瓶构造
3. 容量瓶的使用注意事项
[学生]容量瓶的规格有:50mL,100mL,250mL,500mL和1000mL等。
容量瓶的构造:细颈,梨形的平底玻璃瓶,瓶口配有磨口玻璃塞,瓶身标有温度、容积,瓶颈有刻度线表示容积。
容量瓶的使用注意事项:不能在容量瓶中溶解。
[补充]容量瓶使用注意事项:
(1) 选择合适规格的容量瓶。每一容量瓶只能配制一规定体积的溶液,不能配制任意体积的溶液,因一个容量瓶只有一个刻度。
(2) 使用前要检查是否漏水。
(3) 容量瓶不能加热,不能用作反应器,不能长期贮存溶液。
小结:容量瓶的使用六忌:一忌用容量瓶进行溶解(体积不准确)
二忌直接往容量瓶倒液(洒到外面)
三忌加水超过刻度线(浓度偏低)
四忌读数仰视或俯视(仰视浓度偏低,俯视浓度偏高)
五忌不洗涤玻璃棒和烧杯(浓度偏低)
六忌标准液存放于容量瓶(容量瓶是量器,不是容器)
[讲述]有了这些知识,我们就可以配置此溶液了。
(学生上台演示,其余的在下面观察,发现其操作不当之处)
[板书]二、一定物质的量浓度溶液的配制
1.操作步骤
(1) 计算
(2) 称量
[讲述]由于中学阶段试验条件的限制,我们只能用托盘天平粗略称取。如果是用浓溶液来配稀溶液,可以用滴定管来量取溶液,也可以用量筒粗略量取。
[引导]如何称?要注意哪些问题?
[学生]先放两张相同的称量纸于两托盘上,调零,加入砝码,调节游码,左物右码。
[讲授]接着,将称好的NaCl固体放入烧杯,用适量蒸气水溶解,并用玻璃棒搅拌。将烧杯中的溶液沿着玻璃棒注入容量瓶,轻轻振荡锥形瓶,使溶液混合均匀。玻璃棒在这儿有什么作用?
[学生]引流。
[讲述]将蒸馏水注入容量瓶,液面离容量瓶颈刻度线1~
[板书](3)溶解
(4)恢复至室温
(5)转移
(6)洗涤
(7)振荡
(8)定溶
(9)倒转摇匀
[提问]在这个过程中,都用到了哪些实验仪器?
[学生]烧杯、容量瓶、量筒、玻璃棒、胶头滴管、托盘天平、洗瓶。
[小结]
板书设计
一、物质的量浓度
1.定义:以单位体积的溶液中所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。
符号:c(B) 单位:mol/L 或 mol/m3
2.含义:表示
3.表达式:![]()
符号表示:![]()
二、一定物质的量浓度溶液的配制
1.操作步骤
(1)计算(2)称量(3)溶解(4)恢复至室温(5)转移(6)洗涤(7)振荡
(8)定溶(9)倒转摇匀
课题:第3节 化学中常用的物理量----物质的量(第四课时)
知识与技能:
1.使学生掌握有关物质的量浓度的计算(包括概念计算,与质量分数的换算,加水稀释的计算,气体溶于水的计算);
2.使学生掌握有关配置过程中出现的误差的判断;
3.使学生学会阿伏加德罗定律以及推论的运用;
4.总结物质的量的网络,使知识系统化。
过程与方法:
1.在概念教学中,提高学生的思维能力;
2.培养学生的计算能力,并通过计算帮助学生更好地理解概念和运用、巩固概念;
3.培养学生推理、推导能力。
情感、态度与价值观:
1.通过推导激发学生学习化学的兴趣,培养学生严谨求实的科学作风;
2.通过判断,强调操作规范,养成良好的实验习惯。
教学重点:
物质的量浓度的概念,有关物质的量浓度的计算,一定物质的量浓度溶液的配制。
教学难点:
物质的量浓度与质量分数之间的换算。
气体溶质物质的量浓度的计算。
教学过程:
[讲述]在熟悉了配制步骤和所用仪器后,请大家思考回答下列问题:
1.为什么要用蒸馏水洗涤烧杯,并将洗涤液也注入容量瓶?
2.为什么不直接在容量瓶中溶解?
3.为什么要轻轻振荡锥形瓶,使溶液混合均匀?
[学生1]为了使烧杯壁上留有的溶质,洗涤液中含有的溶质全部转移到溶液中去,使所配溶液浓度尽可能精确。
[学生2]因为大多数物质溶解时伴随吸热或放热过程,引起溶液温度升降,导致定容不准确。
[学生3]可以防止因溶液混合不均引起的误差。
[讲述]此实验是一个比较精确的定量实验,操作时要注意按部就班地做以避免误差的产生。
[板书]2.误差分析
[投影]请根据![]() ,围绕操作作为对n(B)与V的影响而导致c(B)的变化。
,围绕操作作为对n(B)与V的影响而导致c(B)的变化。
(1) 若NaCl中含有杂质(或潮解)。
(2) 水的凹液面超过标线部分用滴管吸去。
(3) 配好摇匀,发现凹液面低于刻度线,再用滴管加水至凹面最低处与刻度相切。
(4) 烧杯和玻璃棒未洗涤。
(5) 容量瓶没有干燥,里面有水。
(6) 定容时俯视。
(7) 量取浓溶液时俯视。
(8) 量取浓溶液时仰视,定容时俯视。
(9) 溶液未冷却即转移和定容。
答案:(1)n(B)偏小c(B)偏小
(2)n(B)偏小c(B)偏小 此时应倒掉重配
(3)V偏大 c(B)偏小
(4)n(B)偏小c(B)偏小
(5)无影响
(6)V偏小c(B)偏小
(7)n(B)偏小c(B)偏小
(8)n(B)偏大 V偏小 c(B)偏小
(9)V偏小c(B)偏小
[课堂小结]配制一定物质的量浓度的溶液,最主要的仪器是容量瓶,其配制步骤、所需仪器与配制一定质量分数的溶液是不同的。
[过渡]接下来,我们一起来做几道有关物质的量浓度的计算题。
1.已知某溶液的密度为d g•cm–3,溶质的质量分数是ω%,溶质的摩尔质量是M g•mol–1,求该溶液的物质的量浓度。
解答:设溶液的体积为V升,则
![]() (mol·L–1)
(mol·L–1)![]() mol·L–1
mol·L–1
答:物质的量浓度为![]() mol·L–1。
mol·L–1。
[小结]这个公式表示了物质的量浓度与质量分数的相互转化,在以后的计算中,这个结论可以直接运用。
2. 50%的NaOH溶液(ρ=
分析与解:用水稀释溶液时,溶液的体积发生了变化,但溶液中溶质的物质的量不变![]() mol·L–1
mol·L–1
根据稀释前后溶质的质量不变 c1V1=c2V2
19.1 mol·L–1 ![]() V1=0.1 mol·L–1
V1=0.1 mol·L–1 ![]() 1000mL
1000mL
V1=5.24mL
3.100mL0.3 mol·L–1 Na2SO4溶液和500mL 0.2 mol·L–1 Al2(SO4)3溶液混合后,溶液中SO42–的物质的量浓度是 。
答案:0.55 mol·L–1
4.标准状况下,a L HCl溶于
A.![]() mol·L–1 B.
mol·L–1 B.![]() mol·L–1
mol·L–1
C.![]() mol·L–1 D.
mol·L–1 D. ![]() mol·L–1
mol·L–1
分析与解:本题考查气体溶于水形成溶液后溶质的物质的量浓度,关键是溶液体积的确定,要用溶液质量除以溶液密度,而不能用气体体积加上水的体积。
从定义出发,先找溶质(HCl),求出其物质的量(![]() ),再找溶液的体积,题目中没有直接给出,可从密度来求溶液的体积(注意单位)。质量包括溶质(
),再找溶液的体积,题目中没有直接给出,可从密度来求溶液的体积(注意单位)。质量包括溶质(![]() mol
mol![]()
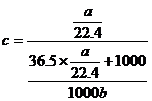 mol·L–1
mol·L–1
答案:D
[指导]通过前面的学习,我们已经了解了物质的量与微粒数以及质量、气体体积、溶液物质的量浓度的关系,请大家以物质的量为中心建立知识网络。
[板书]三、关于物质的量的知识网络
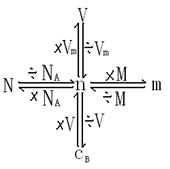
![]() [总结]由此可见,物质的量在微观粒子与宏观物理量之间起到了桥梁作用。
[总结]由此可见,物质的量在微观粒子与宏观物理量之间起到了桥梁作用。
[过渡]化学研究最多的是化学方程式,如2H2 + O2 2H2O,表示的含义是什么?
[学生]可以表示2个氢气分子与1个氧气分子化合生成2个水分子。也可以表示
[提问]学了物质的量,现在,你认为它还可以表示什么意义呢?
[学生]2mol H2与1molO2反应生成2mol H2O,2体积氢气与1体积氧气反应生成一定量的水,标准状况下,
![]() 2H2 + O2 2H2O
2H2 + O2 2H2O
2 1 2
2mol 1mol 2mol
标准状况
[讲述]由此可见,用物质的量来表示方程式最方便,物质的量比就等于方程式前的化学计量数比。
[板书]四、化学方程式:物质的量之比等于方程式前的化学计量数之比
(练习)书25页交流•研讨,完成表格。
[讲述]这一点,在以后的计算中有广泛的应用,用物质的量解题事半功倍。
[练习]练习册P16 4.阿伏加得罗定律推论
[布置作业]书27页 3、4、5
板书设计
2.误差分析
三、关于物质的量的知识网络
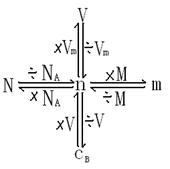
四、化学方程式:物质的量之比等于方程式前的化学计量数之比
[布置作业]书27页 3、4、5
 鲁公网安备 37090202000572号
鲁公网安备 37090202000572号